
重磅!真固生物关联公司全球首款FDA&CE双认证跨癌种伴随诊断NGS-IVD产品上市!
发布时间:2021-09-02 17:13:34 访问次数:
日前,真固生物关联公司及全球战略合作伙伴——Pillar Biosciences宣布,其Onco Reveal™ Dx 肺癌结直肠癌基因检测试剂盒获得美国食品药品监督管理局 (FDA)上市批准。该产品是一种基于组织的 NGS 伴随诊断检测试剂盒,用于检测非小细胞肺癌 (NSCLC) 和结肠直肠癌 (CRC) DNA中的体细胞突变。这也是FDA批准的第一个基于NGS的跨癌种伴随诊断试剂盒,同时也是获得FDA和CE双认证的第一款肿瘤NGS-IVD跨癌种伴随诊断试剂盒。另外真固生物NMPA试剂盒也预计在年底获批(时间轴见文末),这也将预示着真固生物的全球化布局进入新里程!
真固生物和Pillar的共同创始人、首席执行官宋钢博士表示:
“我们致力于提供优质精准的检测IVD,以便为癌症患者做出更好的治疗决策。我们获得FDA批准的产品能用于任何开展NGS检测的实验室,让所有癌症患者都能获得精准医疗。”

FDA官网上查询链接:https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfpma/pma.cfm?id=P200011#
OncoReveal™ Dx肺癌结直肠癌基因检测试剂盒介绍
FDA 批准OncoReveal™ Dx作为指导非小细胞肺癌(NSCLC)患者EGFR TKI疗法和转移性结直肠癌(mCRC)患者Erbitux®(西妥昔单抗)或Vectibix®(帕尼妥单抗)靶向治疗的伴随诊断试剂盒(CDx)。该试剂盒使用Illumina® 因美纳公司的MiSeq Dx™ 仪器进行测序。
U.S.A - FDA-Approved
Indication | Gene | Variant | Targeted therapy |
Colorectal Cancer (CRC) | KRAS |
KRAS wild-type (absence of mutations in codons 12 and 13)
| ERBITUX® (cetuximab), VECTIBIX® (panitumumab) |
Non-Small Cell Lung Cancer (NSCLC) | EGFR |
Exon 19 In Frame Deletions and Exon 21 L858R Substition Mutations
| EGFR Tyrosine Kinase Inhibitors approved by FDA |
Europe and other countries/regions accept CE Mark
Indication | Gene | Variant | Targeted therapy |
Colorectal Cancer (CRC) | KRAS | KRAS wild-type (absence of mutations in codons 12 and 13) |
ERBITUX® (cetuximab), VECTIBIX® (panitumumab)
|
Non-Small Cell Lung Cancer (NSCLC) | EGFR | Exon 19 In Frame Deletions and Exon 21 L858R Substition Mutations |
Tarceva (erlotinib), Gilotrif (afatinib), Iressa (gefitinib), Vizimpro (dacomitinib) |
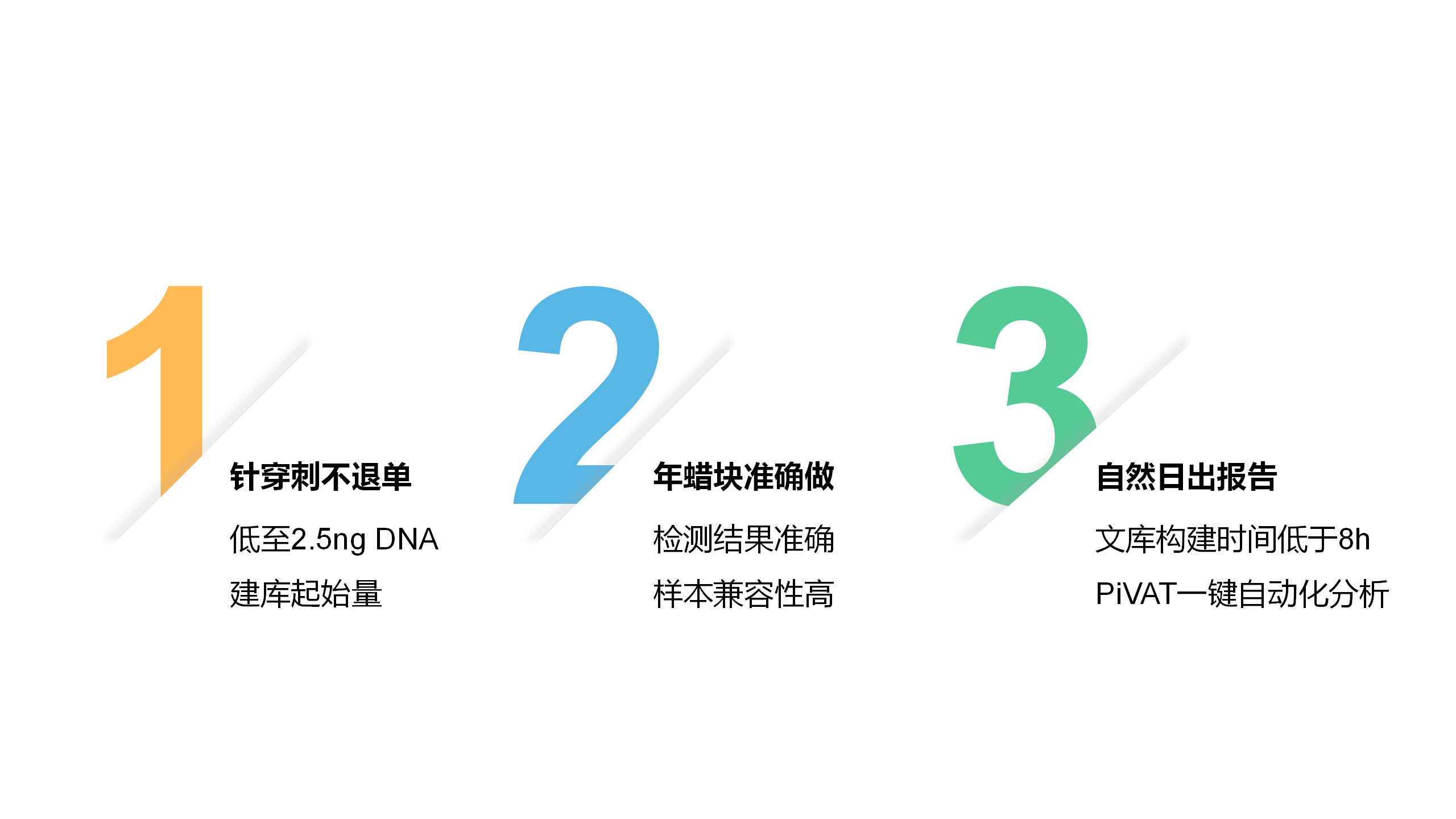
真固生物NGS试剂盒产品优势:
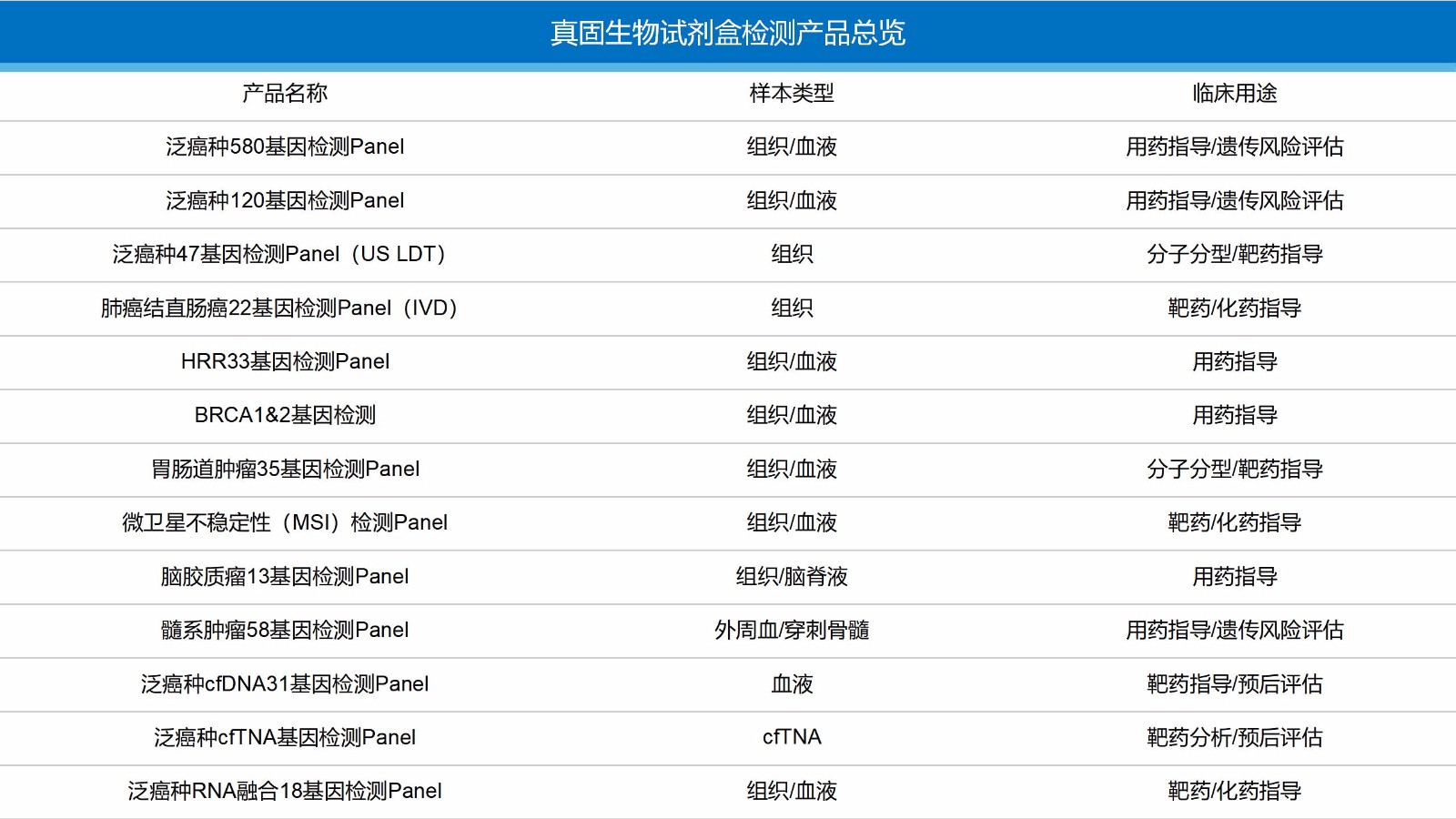
真固生物NGS试剂盒产品总览:
关于Pillar Biosciences
Pillar Biosciences 是一家全球肿瘤解决方案公司,提供准确、可靠、及时、临床可操作的体外诊断试剂盒(IVD),助力实现肿瘤的精准的个体化诊疗。我们的使命是让所有患者在离家更近的地方享受高质量、高性价比的专业临床级 NGS 检测服务。Pillar Biosciences通过简化的NGS工作流程,基于SLIMamp™和PiVAT™的产品帮助NGS实验室和临床肿瘤学实验室提高诊断效率,从而使精准医学触手可及。

